Η παράκαμψη της περιοριστικής διάταξης Carnot του 2ου νόμου της θερμοδυναμικής
Του Πέτρου Ζωγράφου*
Ο λόγος που με ώθησε να πραγματοποιήσω αυτή την ανάλυση είναι η βαθμιαία αλλά σταθερή ανοδική πορεία του ανορθόδοξου τρόπου, που έχει επιλεχθεί και καθιερωθεί για τη μετατροπή της χημικής ενέργειας των καυσίμων σε ηλεκτρική ενέργεια.
Φαίνεται πλέον ξεκάθαρα, ότι ο πλανήτης μας ρυπαίνεται με γεωμετρική πρόοδο και αυτή η ρύπανση οφείλεται κυρίως σε ανθρωπογενή αίτια. Η συνεχώς αυξανόμενη κακή χρήση των υδρογονανθράκων (φυσικού αερίου, πετρελαίου και υποκατάστατων, όπως βενζίνης κλπ.) ως καύσιμης ύλης έχει ξεπεράσει κάθε προηγούμενο και είναι συντελεί στην διαρκή υποβάθμιση του γήινου περιβάλλοντος.
Η χρήση της καύσης του άνθρακα και ειδικά των υδρογονανθράκων με την εδώ και περίπου 150 χρόνια εφαρμοζόμενη μέθοδο μετατροπής τους (χημική – θερμική) σε ηλεκτρική, κινητική κλπ. ενέργεια, μας προσφέρει έναν πολύ μικρό βαθμό απόδοσης. Τούτο οφείλεται στο γεγονός, ότι κάθε θερμική μηχανή έχει απώλειες ενέργειας, που αποβάλλονται υπό μορφή θερμότητας, με συνέπεια η ωφέλιμη ενέργεια της θερμικής μηχανής να είναι κατά πολύ μικρότερη από την αρχική ενέργεια που της δόθηκε.
Εν κατακλείδι, ο δεύτερος νόμος της θερμοδυναμικής υποδηλώνει, ότι σε κάθε θερμικό σύστημα υπάρχει πολύ μεγάλη απώλεια ενέργειας.
O Nicolas Leonard Sadi Carnot διατύπωσε το 1824 τις πρώτες θεωρίες για την μέγιστη απόδοση των θερμικών μηχανών, που έθεσαν τις βάσεις και αργότερα χρησιμοποιήθηκαν από τον Rudolf Clausius αλλά και από τον Λόρδο Kelvin για την ποσοτικοποίηση και οριστικοποίηση του 2ου νόμου της θερμοδυναμικής και τον καθορισμό της έννοιας της εντροπίας. Για τον λόγο αυτό ο Sadi Carnot αναφέρεται συχνά ως «πατέρας της θερμοδυναμικής».
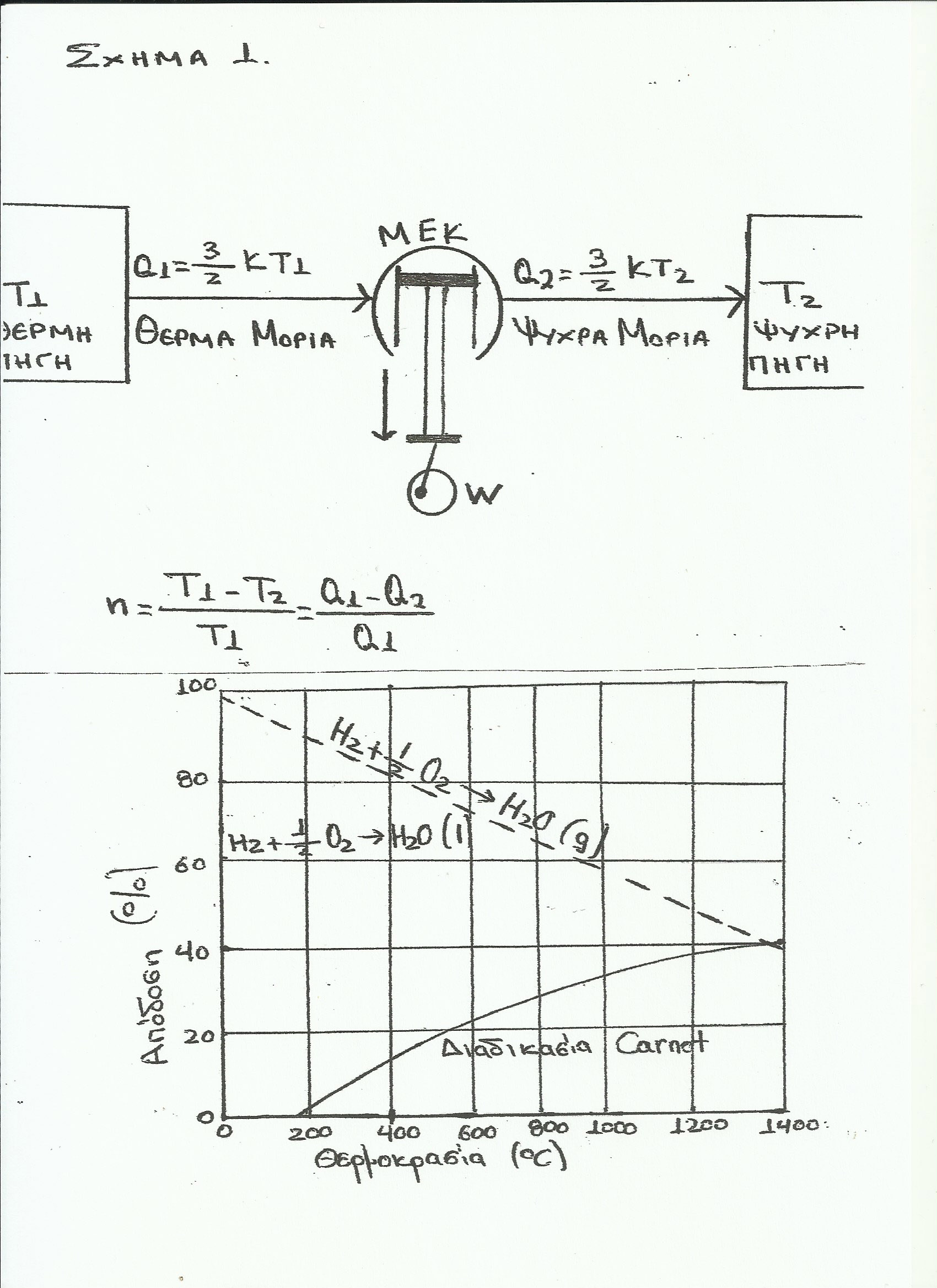
Το θεώρημα Carnot που προτάθηκε το 1824 και ονομάζεται κανόνας του Carnot και καθορίζει τα όρια της μέγιστης απόδοσης των θερμικών μηχανών, αφού σύμφωνα με αυτό η απόδοση μιας θερμικής, μηχανής εξαρτάται αποκλειστικά από τη διαφορά των θερμών και ψυχρών περιοχών. (βλ.σχήμα 3 NASA).
Αναλυτικότερα, για μια τέτοια μετατροπή χημική – θερμική, πρώτα έχουμε την καύση και μετατροπή σε θερμότητα, εν συνεχεία μετατροπή σε μηχανική ενέργεια και σε τρίτο στάδιο μετατροπή σε ηλεκτρική η κινητική ενέργεια.
Στις μηχανές εσωτερικής καύσης, δηλαδή στις μηχανές των αυτοκινήτων, πλοίων και αεροσκαφών που χρησιμοποιούμε μέχρι σήμερα, κατά την πρώτη μετατροπή (ανάφλεξη και καύση) της καύσιμης ύλης (π.χ. βενζίνη) λαμβάνουμε την θερμότητα (θερμική ενέργεια) και από αυτήν εκμεταλλευόμαστε μόνον τα παράπλευρα αποτελέσματα της ολικής καύσης, δηλαδή τα παραγόμενα αέρια, τα οποία στην συνέχεια οδηγούμενα στους αντίστοιχους κυλίνδρους των μηχανών εσωτερικής καύσης πιέζουν τα έμβολα και έχουμε την μετατροπή σε μηχανική ενέργεια, από την οποία μηχανική ενέργεια κατόπιν περαιτέρω μετατροπής λαμβάνουμε την επιθυμητή ηλεκτρική ή κινητική ενέργεια.
Από τις παραπάνω συνεχείς μετατροπές προκύπτει ευχερώς η περιοριστική διάταξη του κύκλου Carnot του 2ου νόμου της θερμοδυναμικής (βλ. σχήμα 3 NASA).
Αξίζει να αναφερθεί, ότι εκείνη την χρονική περίοδο (1824), που διατύπωνε το συγκεκριμένο θεώρημα, ο Leonard Sadi Carnot είχε υπ’ όψιν του μόνον τις μηχανές εσωτερικής καύσης και τις ατμομηχανές.
Αυτού του είδους οι θερμικές μηχανές μετατρέπουν την χημική ενέργεια σε θερμική ενέργεια πριν την μετατροπή σε κινητική ή ηλεκτρική ενέργεια, έτσι ώστε λόγω της «έμμεσης» ενδιάμεσης παραγωγής μηχανικής και θερμικής ενέργειας να έχει εφαρμογή η περιοριστική αρχή του κύκλου Carnot του 2ου νόμου της θερμοδυναμικής, που καθορίζει μερική, ουσιαστικά πολύ μικρή μετατροπή της αρχικής ενέργειας σε ηλεκτρική ή κινητική.
Η φύση όμως έχει επιλέξει έναν εντελώς διαφορετικό τρόπο να παράγει ενέργεια, όπως π.χ. στους βιολογικούς οργανισμούς, όπου παρατηρείται η μέγιστη απόδοση κατά την μετατροπή ενέργειας χωρίς να προκαλείται και μόλυνση του περιβάλλοντος.
Αυτή η μετατροπή ενέργειας στους βιολογικούς οργανισμούς επιτυγχάνεται με την διαδικασία της «οξειδοαναγωγής», ως εξής :
Από χημική άποψη η «οξείδωση» αναφέρεται στην απώλεια ηλεκτρονίων. Η οξείδωση του άνθρακα σημαίνει, ότι τα άτομα του άνθρακα στο καύσιμο χάνουν ηλεκτρόνια καθώς μετατρέπονται σε διοξείδιο του άνθρακα, τα δε ηλεκτρόνια που χάνονται ανήκουν σε άτομα υδρογόνου, τα οποία αποτελούνται από ένα πρωτόνιο και ένα ηλεκτρόνιο.
Αυτή η αντίδραση οξείδωσης συνδέεται χημικά με μια αντίδραση αναγωγής, που η επιστήμη της χημείας ορίζει ως αντιδράσεις «οξειδοαναγωγής». Όταν ένα άτομο χάνει ηλεκτρόνια («οξείδωση»), ένα άλλο άτομο κερδίζει («αναγωγή»), αφού κατά την καύση του “καυσίμου” τα ηλεκτρόνια (στα άτομα υδρογόνου) μεταφέρονται από τον άνθρακα στο οξυγόνο. Όπως τα άτομα αναδιατάσσονται, τα μεταφερόμενα ηλεκτρόνια απελευθερώνουν ενέργεια, η οποία “συλλαμβάνεται” από τα κύτταρα του οργανισμού στο ATP (ΜΙΤΟΧΟΝΔΡΙΟ).
Η ως άνω διαδικασία μετατροπής ενέργειας, που έχει επιλεγεί από την φύση, ουδεμία σχέση έχει με τις συνήθεις διαδικασίες παραγωγής ενέργειας από τα ορυκτά καύσιμα, αφού τα περισσότερα τέτοια μηχανήματα που κατασκευάζονται από ανθρώπους χρησιμοποιούν πολύ λιγότερο την χημική ενέργεια από το καύσιμο τους (μεταξύ 8% – 22%), όπως π.χ. τα αυτοκίνητα που αξιοποιούν-εκμεταλλεύονται κατά μέσον όρο μόνον το 22%, ως αποτέλεσμα της εφαρμογής του 2ου νόμου της θερμοδυναμικής, ήτοι : n = T1 – T2 / T1 = Q1 – Q2 / Q1
Επομένως, πρέπει να επαναδιατάξουμε τις προσπάθειές μας προς μια τεχνολογία «ψυχρής» μετατροπής των καυσίμων, αντί της «χημικής – θερμικής» που εφαρμόζεται μέχρι σήμερα.
Κατωτέρω παραθέτω την εξήγηση, για ποιους λόγους πρέπει να γίνει αυτή η μετάβαση από την θερμική προς την ψυχρή μετατροπή.
Πρώτα από όλα, οφείλουμε να κατανοήσουμε, ότι η βάση της λειτουργίας των ψυχρών μετατροπών είναι η φυσικοχημική μεταβολή που λαμβάνει χώραν εντός αυτών ή στο εσωτερικό τους.
Από ενεργειακής απόψεως, το μέγιστο δυνατό μηχανικό έργο μπορεί πραγματικά να παρέχεται από την αντιστρεπτή θερμοδυναμική μεταφορά χημικού συστήματος από μια κατάσταση σε μία άλλη με την εκμετάλλευση της ελεύθερης ενέργειας ΔG του χημικού συστήματος.
Για να πετύχουμε λοιπόν τον μέγιστο βαθμό αποδόσεως, είναι απαραίτητο να εργάζεται μια διάταξη σε απολύτως αντιστρεπτές συνθήκες. Όσο το ρεύμα ανταλλαγής είναι μεγαλύτερο και όσο η αντίσταση του ύδατος με την παρουσία κράματος υλικών είναι μικρότερη, τόσο πιο καλά μπορεί να πραγματοποιηθεί η λειτουργία της διάταξης σε απολύτως αντιστρεπτές συνθήκες.
Ως παράδειγμα, μπορούμε να θεωρήσουμε μια αντίδραση, όπου το νερό μετατρέπεται με βρασμό αναστρέψιμα σε ατμό. Για να είναι αναστρέψιμη η αντίδραση, ας υποθέσουμε ότι το μείγμα νερού και ατμού περιέχεται σε έναν κύλινδρο με κινητό έμβολο και διατηρείται σε σημείο βρασμού με πίεση μιας ατμόσφαιρας από μια δεξαμενή θερμότητας.
Η αλλαγή ενθαλπίας είναι : ΔΗ = 40,65 kilojoules ανά mole, η οποία είναι η λανθάνουσα θερμότητα εξάτμισης. Η αλλαγή εντροπίας είναι :
Δ S = 40,65 / 373 = 0,109 kilojoules ανά γραμμομόριο . Κ
που αντιπροσωπεύει τον μεγαλύτερο βαθμό διαταραχής, όταν το νερό εξατμίζεται και μετατρέπεται σε ατμό. Η ελεύθερη ενέργεια γνωστή και ως λειτουργία Gibbs ορίζεται ως G=H-Tδ όπου το S αναφέρεται στην εντροπία του συστήματος. Έτσι για κάθε αλλαγή στην κατάσταση, μπορούμε να γράψουμε την εξαιρετικά σημαντική σχέση ΔG=ΔΗ-ΤΔS
Η ελεύθερη αλλαγή ενέργειας Gibbs είναι : ΔG = ΔΗ – ΤΔ S . Στην περίπτωση αυτή η ελεύθερη αλλαγή ενέργειας Gibbs ισούται με το μηδέν, επειδή ο ατμός και το νερό ευρίσκονται σε ισορροπία και δεν μπορεί να εξαχθεί χρήσιμο έργο από τον συγκεκριμένο μηχανισμό (εκτός από το έργο μέσω της ατμόσφαιρας). Με άλλα λόγια, ελεύθερη ενέργεια Gibbs ανά μόριο νερού (ονομαζόμενη επίσης «χημικό δυναμικό») είναι η ίδια, τόσο για το νερό σε υγρή μορφή όσο και για τον ατμό, αφού με τον τρόπο αυτό τα μόρια του νερού μπορούν να περνούν ελεύθερα από την μια φάση στην άλλη, χωρίς να αλλάζουν την συνολική ελεύθερη ενέργεια του συστήματος.
Με αντίστοιχο θερμοδυναμικά αντιστρεπτό τρόπο και χρησιμοποιώντας την ψυχρή καύση επιτυγχάνεται η ελάττωση της αποδιδόμενης στο περιβάλλον ελεύθερης ενέργειας (ΔG) κατά την ένωση του άνθρακα με το οξυγόνο και κατά συνέπεια η εκμετάλλευση μεγάλου ποσού μηχανικής ενέργειας.
Λίγα λόγια για τον παρεξηγημένο όρο εντροπία
Όταν έχουμε ένα ποτήρι ζεστό γάλα το οποίο κρυώνει, τότε η εντροπία του μειώνεται, Δεν αυξάνει. Όμως η εντροπία του περιβάλλοντος αυξάνει ακόμα περισσότερο αφού το ζεστό γάλα είναι θερμότερο από το περιβάλλον.
Ερώτημα: Μπορούμε να καταρρίψουμε την αλλαγή της εντροπίας που προκύπτει από αλλαγές στις συγκεκριμένες ιδιότητες του συστήματος μας? Υπάρχουν αλλαγές σε πέντε πράγματα που θα οδηγήσουν σε μια αλλαγή στην εντροπία του συστήματος.
- Οι αλλαγές στη θερμοκρασία θα προκαλέσουν αλλαγές στην εντροπία Όσο μεγαλύτερη είναι η θερμοκρασία τόσο μεγαλύτερη είναι η θερμική ενέργεια που έχει το σύστημα. Όσο πιο μεγάλη θερμική ενέργεια έχει το σύστημα, τόσο πιο πολλοί τρόποι υπάρχουν για την διανομή της ενέργειας. Όσο πιο πολλοί τρόποι υπάρχουν για να μοιραστεί αυτή η ενέργεια, τόσο μεγαλύτερη είναι η εντροπία. Η αύξηση της θερμοκρασίας θα αυξήσει την εντροπία.
- Οι αλλαγές στον όγκο θα οδηγήσουν σε αλλαγές στην εντροπία. Όσο μεγαλύτερος είναι ο όγκος, τόσο πιο πολλοί τρόποι υπάρχουν για τη διανομή των μορίων σε αυτόν τον όγκο, όσο πιο πολλοί τρόποι υπάρχουν για τη διανομή των μορίων (ενέργεια), τόσο μεγαλύτερη είναι η εντροπία. Η αύξηση της έντασης θα αυξήσει την εντροπία.
- Αλλαγές στη φάση θα οδηγήσουν σε αλλαγές στην εντροπία. Ορισμένες φάσεις έχουν μεγαλύτερο αριθμό συχνοτήτων και συνεπώς υψηλότερη ενέργεια. Τα στερεά δονούνται σε χαμηλότερες συχνότητες και επομένως τη μικρότερη εντροπία. Τα υγρά έχουν περισσότερες μικροσκοπικές μονάδες υψηλότερες συχνότητες και έτσι έχουν υψηλότερη εντροπία. Όταν μια ουσία είναι αέριο, έχει πολλές περισσότερες μικροσκοπικές μονάδες και έχει υψηλότερη εντροπία.
- Η μίξη των ουσιών αυξάνει την εντροπία. Αυτό οφείλεται στο γεγονός ότι υπάρχουν πολλά περισσότερα μικροστοιχεία για το μικτό σύστημα χωρίς ανάμιξη. Περισσότερες συχνότητες (μικροκέντρα) σημαίνουν μεγαλύτερη εντροπία. Αυτό είναι ένα από τα παραδείγματα από τα οποία προκύπτει η εσφαλμένη αντίληψη ότι η εντροπία είναι διαταραχή.
- Τέλος η εντροπία μπορεί να αλλάξει ως αποτέλεσμα χημείας. Τα διάφορα μόρια έχουν διαφορετικέ εντροπίες. Έτσι μπορεί να είναι δύσκολο να κοιτάξετε μια αντίδραση και να μαντέψετε εάν ανεβαίνει η κατεβαίνει. Εντούτοις γενικά αν τα προϊόντα έχουν μεγαλύτερο αριθμό μορίων από τα αντιδρώντα τότε η εντροπία μπορεί να αυξηθεί. Εάν τα βρίσκονται σε φάσεις υψηλότερης εντροπίας από τα αντιδρώντα η αντίδραση πιθανόν να έχει μεγαλύτερη εντροπία π.χ 2Fe(s)+3O2(g) > 2Fe2O3(ες)ΔSr<O). Η αλλαγή στην εντροπία γι αυτήν την αντίδραση θα είναι αρνητική. Αυτό επειδή τα αντιδραστήρια έχουν τόσο ένα στερεό όσο και ένα αέριο, ενώ το προϊόν είναι απλώς μια στερεή ένωση.
ΑΝΑΛΥΣΗ ΧΗΜΙΚΗΣ – ΘΕΡΜΙΚΗΣ ΜΕΤΑΤΡΟΠΗΣ ΤΩΝ ΚΑΥΣΙΜΩΝ (ΥΔΡΟΓΟΝΑΝΘΡΑΚΩΝ κλπ.)
Ο μηχανισμός της χημικής – θερμικής μετατροπής της ενέργειας σε κινητική και κατόπιν σε ηλεκτρική μπορεί να εξηγηθεί απλά βάσει της κινητικής θεωρίας των μορίων, όπου η μεταβολή στην ενέργεια μεταξύ των αρχικών στοιχείων και των αποτελεσμάτων της δράσης εκδηλώνεται ως θερμότητα.
Αν εξετάσουμε μια Μηχανή Εσωτερικής Καύσης , όταν πυροδοτηθεί η καύση του καυσίμου προκαλείται κινητική ενέργεια των μορίων των θερμανθέντων αερίων συστατικών της δράσης και αυτά (τα μόρια των αερίων) προσκρούουν π.χ. στο πιστόνι της Μηχανής Εσωτερικής Καύσης, αλλά δυστυχώς η μεταφορά της ορμής τους σε αυτό το πιστόνι δεν είναι ολοκληρωμένη . Έτσι η κινητική ενέργεια ανά Κελβίνο ΄΄μονοατομικό ιδανικό αέριο΄΄ είναι 3[R/2] =3R/2: ανά γραμμομόριο: 12.47 J. Ανά μόριο: 20.7 yJ = 129μev. Σε κανονική θερμοκρασία 273.15Κ παίρνουμε: Ανά γραμμομόριο: 3406 J και ανά μόριο: 5.65 ZJ = 35.2 mev
Ο όγκος της μεταφοράς του ποσοστού κινήσεως αυτών των μορίων (κινητική ενέργεια κάθε μορίου) υπολογίζεται με τον τύπο :(3/2 ΚΤ).
Με δεδομένο ότι η θερμοκρασία του μορίου είναι Τ1 πριν την σύγκρουσή του και μεταβάλλεται σε Τ2 μετά την σύγκρουση και απομάκρυνση από το πιστόνι, τότε η μετατρεπόμενη ενέργεια ανά μόριο θα καθορίζεται από την εξίσωση: 3/2ΚΤ1/ – 3/2 ΚΤ2
Το μικρό ποσοστό ενέργειας, που παραμένει στο μόριο, δεν μπορεί να γίνει αντικείμενο εκμετάλλευσης με οποιονδήποτε μέχρι σήμερα γνωστό τρόπο, καθ’ όσον μεταφέρεται μετά την πρόσκρουση από το μόριο στο πιστόνι, που αποτελεί το αντίθετο της θερμής πηγής, δηλαδή την ψυχρή πηγή. n=3/2KT1-3/2ΚΤ2/3/2ΚΤ1=Τ1-Τ2/Τ1.
Και εδώ συνίσταται το πρόβλημα του τελικού βαθμού απόδοσης στην χημική – θερμική μετατροπή για τις συμβατικές μηχανές εσωτερικής καύσης, ο οποίος (τελικός βαθμός απόδοσης) είναι αυτός που προβλέπεται πολύ σωστά έως εδώ, από την περιοριστική διάταξη του κύκλου Carnot του 2ου θερμοδυναμικού νόμου.
Αντιθέτως, στον αντιδραστήρα ψυχρής καύσης δεν υπάρχουν ούτε κρούσεις ούτε τριβές αλλά ούτε και θερμοκρασίες, που συνεπάγονται ενεργειακές απώλειες, αλλά μόνον κινήσεις ηλεκτρονίων: 2H2 > 4H+ + 4e–Αποβολ. Ο2 + 4H+ + 4e– > 2H2O προσλ.
Λόγω της ανωτέρω διαδικασίας, μπορούμε να λάβουμε ηλεκτρική ενέργεια μέσω ενός εξωτερικού ηλεκτρικού φορτίου καταλλήλου αντιστάσεως, μόνον μια ελάχιστη διαφορά ανάμεσα στη (-ΔG) και στη (-ΔΗ) μπορεί να διαπιστωθεί, η οποία διαφορά ισούται με τον πολύ μικρό εντροπικό όρο ΤΔs, που σε τελική ανάλυση είναι άνευ αξίας. Όσο μικρότερος είναι ο εντροπικός όρος ΤΔS τόσο μεγαλύτερο βαθμό απόδοσης έχει ο αντιδραστήρας ψυχρής καύσης εάν ληφθεί υπόψιν και o ΔΗ. Το ιδανικό πρότυπο δυναμικό ενός στοιχείου του αντιδραστήρα ψυχρής καύσης είναι Η2/Ο2 (Ε0) και είναι 1228mv με υγρό νερό σαν αποτέλεσμα, και 1217mv για νερό με αέριο. Αυτή η τιμή είναι το δυναμικό οξείδωσης του υδρογόνου, Το δυναμικό αυτό το ονομάζουμε και ως αλλαγή στην ελεύθερη ενέργεια του Gibbs για την δράση υδρογόνου και οξυγόνου. Η ελεύθερη ενέργεια του Gibbs αυξάνεται καθώς μειώνεται η θερμοκρασία του αντιδραστήρα σε σχέση με της θερμικές μηχανές εσωτερικής καύσης, όπου συμβαίνει ακριβώς το αντίθετο, δηλαδή όσο αυξάνεται η θερμοκρασία (διαφορά θερμού-ψυχρού) αυξάνεται και ο βαθμός απόδοσης τους.
Για την πληρέστερη κατανόηση της θερμικής – χημικής μετατροπής παρατίθεται το αντίστοιχο σχήμα του μηχανικού αναλόγου (σχήμα 1).
ΘΕΡΜΟΔΥΝΑΜΙΚΗ ΑΝΑΛΥΣΗ ΓΙΑ ΤΗΝ ΜΕΤΑΤΡΟΠΗ ΣΕ ΗΛΕΚΤΡΙΚΗ ΕΝΕΡΓΕΙΑ ΜΕΣΩ ΤΗΣ ΜΕΘΟΔΟΥ ΨΥΧΡΗΣ ΔΙΑΔΙΚΑΣΙΑΣ
Πρέπει να γνωρίζουμε, ότι οι θερμοδυναμικοί υπολογισμοί βασίζονται στο γεγονός, ότι οι χημικές μεταβολές γίνονται κοντά στην κατάσταση ισορροπίας. Η τάση ενός αντιδραστήρα ψυχρής καύσης είναι περίπου ίση με την τάση της θερμοδυναμικής ισορροπίας, δηλαδή ο αντιδραστήρας ψυχρής καύσης λειτουργεί ως »ισοθερμική στατική μηχανή», οπότε δεν έχει ανάγκη δύο διαφορετικών πηγών θερμοκρασίας δηλαδή μιας δεξαμενής υψηλής θερμοκρασίας, και μιας δεξαμενής χαμηλής θερμοκρασίας (αρχή Carnot δεύτερος νόμος της θερμοδυναμικής – (βλ. σχήμα 3 NASA).
Όπως προβλέπεται από τον δεύτερο νόμο της θερμοδυναμικής και την συναφή περιοριστική διάταξη Carnot, «θερμικές μηχανές» είναι οι μηχανές που παράγουν έργο στηριζόμενες σε θερμιδικά φαινόμενα, ενώ για να λειτουργήσουν απαιτείται η περιοδική μεταβολή της θερμοκρασίας κάποιου «σώματος» ύλης, συνήθως κάποιου αερίου.
Η μεταβολή της θερμοκρασίας αυτού του σώματος γίνεται με μεταφορά θερμότητας, δηλαδή προσδίδεται αρχικά στο σώμα θερμική ενέργεια, ήτοι αυξάνεται η θερμοκρασία του, οπότε τότε το σώμα αποβάλλει την ενέργεια παράγοντας έργο, με σκοπό να επανέλθει στην αρχική του κατάσταση και να προσλάβει και πάλι ενέργεια (πχ βενζίνη, πετρέλαιο, φυσικό αέριο, κλπ.). Η ανωτέρω διαδικασία ονομάζεται κύκλος λειτουργίας.
Σύμφωνα δε με τον δεύτερο νόμο της θερμοδυναμικής, σε κάθε κύκλο λειτουργίας υπάρχει ένα πολύ μεγάλο ποσόν ενέργειας, το οποίο αποβάλλεται από το σώμα όχι με την μορφή έργου, αλλά με την μορφή θερμότητας, προκαλώντας έτσι μεγάλη απώλεια ενέργειας.
Όμως, ένας αντιδραστήρας ψυχρής καύσης μετατρέπει την χημική ενέργεια απευθείας σε ηλεκτρική ενέργεια, παρακάμπτοντας με τον τρόπο αυτό την ανεπάρκεια που σχετίζεται με την μετατροπή της θερμικής ενέργειας, έτσι ώστε η διαθέσιμη ενέργεια να είναι ίση με την ελεύθερη ενέργεια Gibbs. Η απόδοση του αντιδραστήρα ψυχρής καύσης διέπεται από την καμπύλη πόλωσής του.
Για να κατανοήσουμε την απόδοση που έχει μια ψυχροδυναμική μετατροπή ενέργειας δεδομένης χημικής δράσης σε ηλεκτρική ενέργεια έχουμε: – ΔG =(Wa–PΔV) και η μέγιστη χρήσιμη εργασία που λαμβάνεται από τον αντιδραστήρα ψυχρής καύσης είναι: dG = dH – TdS . Όπου W δίνεται από το : ΔG ( ή NFE ).
Βάσει της ανωτέρω σχέσης η μείωση της ελεύθερης κατά Gibbs ενέργειας για μια δράση ισούται με το αντιστρεπτά ολικό έργο μείον το έργο διαστολής του συστήματος. Εάν ωθήσουμε να πραγματοποιηθεί μια δράση με ψυχροδυναμικό τρόπο και εάν τροφοδοτήσουμε αυτή την δράση με υδρογόνο και οξυγόνο και σαν απόβλητο αυτής της διαδικασίας σχηματιστεί νερό (Η2O), τότε έχουμε: 2H2 + O2 > 2H2O
Όπως αντιλαμβάνεται κανείς, έχουμε μια αλλαγή στην ελεύθερη ενέργεια ΔG της διάταξης 2H2 + O2.
Εάν όμως παρατηρήσουμε το φαινόμενο με μεγαλύτερη λεπτομέρεια, θα διαπιστώσουμε ότι έχουμε μια μεταφορά 4 ηλεκτρικών φορτίων μέσω μιας ολικής διαφοράς δυναμικού Ε εν κενώ, ή μιας τάσης U υπό φορτίο. Σε γενικές γραμμές όταν έχουμε μεταφορές ηλεκτρονίων σε κάθε μόριο του κράματος που βρίσκεται εντός του αντιδραστήρα ψυχρής καύσης, τότε το ηλεκτρικό έργο θα εξαρτάτε από την εξίσωση: Wh= Q .V και πρέπει να γνωρίζουμε όταν γίνεται μεταφορά ηλεκτρονίων σε κάθε μόριο του κράματος υλικών του αντιδραστήρα ψυχρής καύσης τότε το ηλεκτρικό έργο θα είναι Whl = n FE για κάθε mole του κράματος υλικών που βρίσκεται αναμεμιγμένο εντός του νερού. Ανάλογη επίσης θα είναι και η μείωση στην ελεύθερη ενέργεια της εκάστοτε διαδικασίας. Πχ για 2Η2 + Ο2 > 2Η2Ο οπότε θα έχουμε -ΔG = nFE
Επομένως τα v/ – v// = – dζ / de όπου v/ και v // δηλώνουν τα ηλεκτρικά δυναμικά του κράματος υλικών, το de είναι μια διαφορική ποσότητα ηλεκτρικής ενέργειας, και το dζ (διαφορά ΖΗΤΑ) είναι η μεταβολή της διαθέσιμης ενέργειας, η ισοθερμική ισοβαρική ελεύθερη ενέργεια GGbs dG, που ΔF = – NFE, αν το Δ είναι η ελεύθερη ενέργεια Lewis στη θέση της ελεύθερης ενέργειας G ή Gibbs, το F είναι ισοδύναμο Faraday και το N αντί του n είναι ο αριθμός των ισοδυνάμων που διέρχονται μέσω του αντιδραστήρα ψυχρής καύσης όταν η δράση συμβαίνει, όπως έχει γραφτεί.
Αν η τάση του ψυχροδυναμικού αντιδραστήρα ήταν ακριβώς ίση με την τάση ισορροπίας, τότε όλη η ΔG της διαδικασίας της δράσης θα μετατρεπόταν σε ηλεκτρική ενέργεια και θα ήταν ίση με – nFE , οπότε ο αντιδραστήρας ψυχρής καύσης θα είχε βαθμό απόδοσης 100% . Δηλαδή μια αρκετά υψηλή απόδοση, που δεν παρατηρείται σε καμία θερμική μηχανή μέχρι σήμερα.
Εκ των ως άνω αναλύσεων προκύπτει, ότι οι αποδόσεις μετατροπής με βάση αυτήν την πρόταση είναι κατά πολύ μεγαλύτερες από τις αποδόσεις των θερμικών μετατροπών, οι οποίες μετά βίας αγγίζουν το 22% λόγω της απώλειας ενέργειας και της συνακόλουθης εφαρμογής της περιοριστικής διάταξης του κύκλου Carnot του 2ου νόμου της θερμοδυναμικής.
Τονίζω, ότι και σε αυτή την θέση η μεταβολή της ελεύθερης ενέργειας της διαδικασίας, η οποία μετατρέπεται σε ηλεκτρικό έργο, διαφέρει από την μεταβολή της ενθαλπίας ΔΗ της αντίστοιχης δράσεως.
Μπορούμε να συμπεράνουμε, ότι η θερμότητα που παρουσιάζεται στην διαδικασία, στην περίπτωση που αυτή ελάμβανε χώρα καθαρά χημικώς θα είχε μια μικρή διαφορά από την ελάττωση στην ελεύθερη ενέργεια, ήτοι από το παραγόμενο ηλεκτρικό έργο, κάτι που προκύπτει εύκολα από την θερμοδυναμική εξίσωση του Gibbs:
ΔG = ΔH + T . [(d (ΔG) / dT)]. Για μια δεδομένη δράση ΔG0 = G0προ– G0αντι
Λόγω των ανωτέρω αλλά και της παραμέτρου -ΔG = nFE , λαμβάνουμε την γνωστή θερμοδυναμική εξίσωση των g.e: ΔΗ = ΔG + nFT (dE / dT).
Το αποτέλεσμα nF (dE / dT) μας δίνει την αλλαγή της εντροπίας Δs της διαδικασίας, εφ’ όσον ΔΗ = ΔG + T Δs, ενώ το (dE/dT) μας υποδεικνύει τον θερμικό συντελεστή του δυναμικού του αντίστοιχου ψυχροδυναμικού στοιχείου του αντιδραστήρα ψυχρής καύσης. Για να έχουμε όμως σωστά αποτελέσματα στα ανωτέρω, απαραίτητη προϋπόθεση είναι ότι το όλο σύστημα πρέπει να λειτουργεί υπό σταθερή πίεση.
Σε εντελώς αντιστρεπτές συνθήκες των διαδικασιών, ο θερμικός συντελεστής ισούται με το μηδέν (0), και ο εντροπικός όρος ΤΔs δεν συμμετέχει στην περίπτωση αυτή στην θερμοδυναμική εξίσωση, έτσι έχουμε: (- ΔG) = ( – ΔΗ).
Όταν όμως ο αντιδραστήρας ψυχρής καύσης, είναι υπό φορτίο και τροφοδοτεί με ηλεκτρικό ρεύμα κάποια ηλεκτρικά φορτία τα οποία μπορεί να είναι ωμικά, επαγωγικά ή σύνθετα, μειούμενο το Ε, παρουσιάζεται μια πάρα πολύ μικρή αύξηση σχεδόν αμελητέα της θερμοκρασίας του, έτσι έχουμε: (dE / dT) <0 που σημαίνει ότι θα έχουμε πλέον σε πλήρη εφαρμογή την εξίσωση ( -ΔG ) < ( -ΔH ). Αυτά όμως συμβαίνουν όταν η καρδιά του αντιδραστήρα (cavity) δεν διατηρείται σε χαμηλές θερμοκρασίες.
Όταν όμως διατηρείται σε χαμηλές θερμοκρασίες παρατηρείται ότι ( dE/dT ) > 0, άρα κατά την εργασία του αντιδραστήρα ψυχρής καύσης μειούμενο το Ε μειώνεται και η θερμοκρασία του. Τότε θα έχουμε, (-ΔG) > (-ΔH).
Από όσα παρατηρούμε με έκπληξη στην συγκεκριμένη περίπτωση, λαμβάνουμε επί πλέον κέρδος ενέργειας, που το παίρνουμε από το περιβάλλον. Τούτο συμβαίνει, γιατί η θερμοκρασία του αντιδραστήρα ψυχρής καύσης μειούται σε επίπεδο πολύ χαμηλότερο από την θερμοκρασία του περιβάλλοντος, γεγονός που έχει ως αποτέλεσμα και την μετατροπή μέρους της θερμοκρασίας του περιβάλλοντος σε ηλεκτρικό έργο μέσω ενός θερμοηλεκτρικού στοιχείου, που τροφοδοτεί με τάση μόνον κάποιους ηλεκτρονόμους (ρελέ) του συστήματος.
Σε γενικές γραμμές όμως το αποτέλεσμα της εξίσωσης (-ΔG) / (-ΔΗ) δεν ισούται με το 100% οπότε ο βαθμός αποδόσεως του αντιδραστήρα ψυχρής καύσης βάσει της ΔΗ θα είναι ελάχιστα πιο χαμηλός.
Η θεωρητική τάση στον αντιδραστήρα ψυχρής καύσης είναι ανάλογη προς το ΔG, ήτοι : V = ΔG / nF. Λαμβάνοντας υπ όψιν όλα τα παραπάνω:
Ορίζουμε πλέον την πτώση τάσης ενεργοποίησης με την εξίσωση:
Va= RT / a2F ln ( l/l0 ) = T [a + bln (I)] = Va+ Vact2
Η αναστρέψιμη τάση σε έναν αντιδραστήρα ψυχρής καύσης μπορεί να υπολογιστεί από την σχέση : Ε = ΔGO / NF.
Από τα προεκτεθέντα προκύπτει αβίαστα το συμπέρασμα, ότι η ενεργειακή απόδοση των αντιδραστήρων ψυχρής καύσης, όταν πραγματοποιείται ψυχροδυναμικά, διαφέρει σημαντικά ως προς τον βαθμό απόδοσης σε σχέση με την πραγματοποίησή της χημικά – θερμικά, η οποία εφαρμόζεται μέχρι σήμερα κατά κόρον για την παραγωγή ηλεκτρικής ενέργειας και που έχει ως αποτέλεσμα την θερμική μόλυνση και την αλόγιστη ρύπανση του πλανήτη. Όμως, για την ψυχρή καύση με το Ο2 έχουμε:
– nFE / ΔΗ ή αλλιώς το κλάσμα ΔG / ΔΗ. Εάν η ΔG0 = 265 KJ / mol και η ΔΗ0 = 271 KJ / mol. τότε καταλήγουμε σε βαθμό απόδοση περίπου 98%
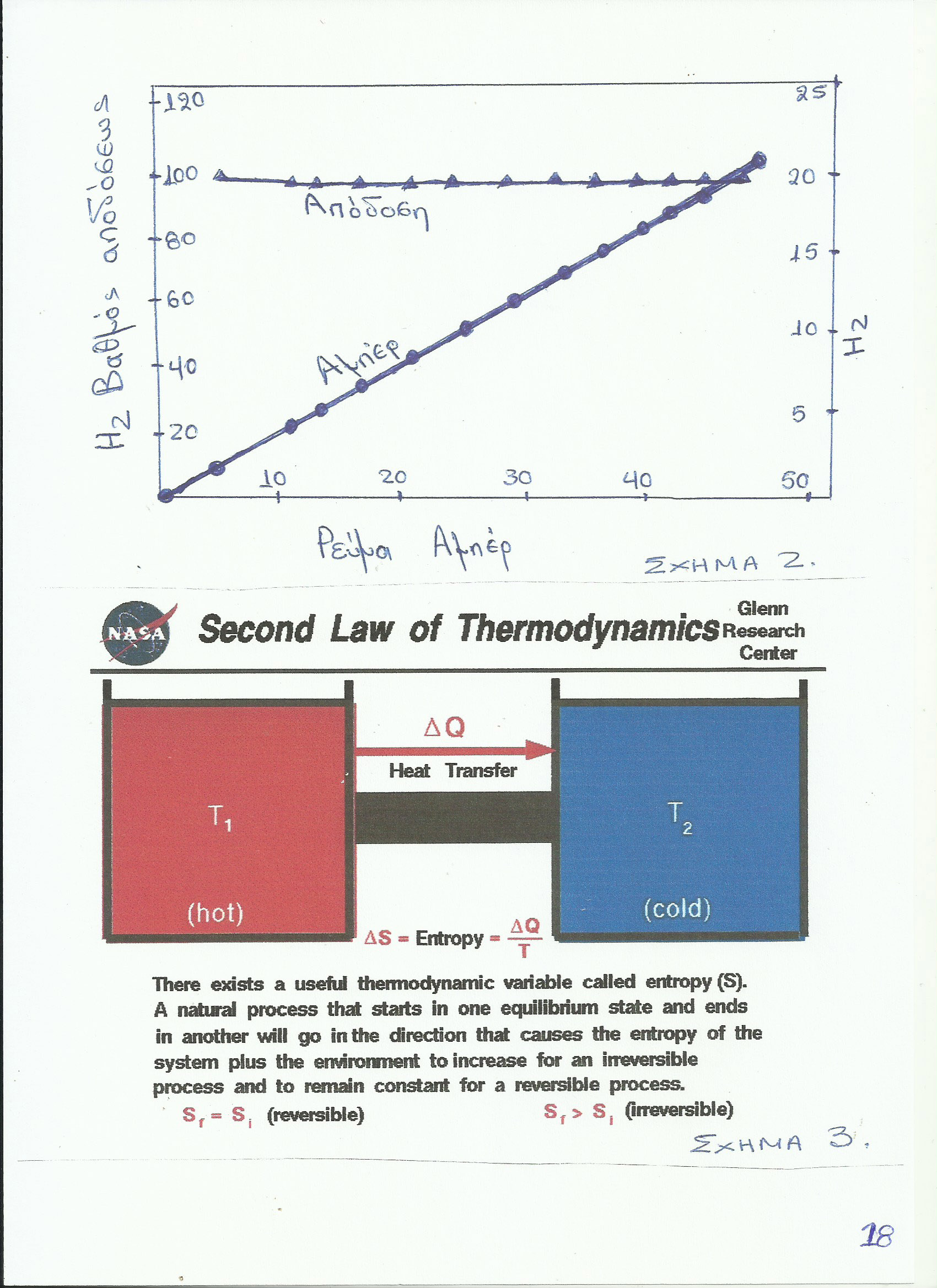
Στο παρατιθέμενο Σχήμα 2 διακρίνουμε σε γενικές γραμμές τον πολύ μεγάλο βαθμό αποδόσεως του αντιδραστήρα ψυχρής καύσης σε συνάρτηση με το ρεύμα εξόδου και την ροή εισόδου (κράμα υλικών + νερό) του συστήματος.
Στην συνέχεια αποδεικνύεται, ότι, κάτω από συγκεκριμένες συνθήκες θερμοκρασίας και πίεσης και βάσει ειδικών κραμάτων, είναι δυνατόν ο βαθμός απόδοσης ενός αντιδραστήρα ψυχρής καύσης να φθάσει σε υπερβολικά υψηλό επίπεδο, που πολλές φορές να φαίνεται ότι τείνει να υπερβαίνει το 100%.
Παραδείγματος χάριν, για μια διάταξη C + 1/2 O2 > CO, όπου το (-ΔG) είναι 32,811 Kcal και το (-ΔΗ) είναι 27,411 Kcal ενώ το Ε είναι 0,7121 , τότε η χημική διαδικασία προκαλεί, όπως δείχνουν οι υπολογισμοί, μια γ. απόδοση της χ.α. της τάξης του 117,85% περίπου, οπότε σε αυτή την περίπτωση, όπως παρατηρούμε, παρουσιάζεται αύξηση της εντροπίας, ήτοι : (Δs > 0) της διαδικασίας. Τα ως άνω συμβαίνουν, όταν η καρδιά του αντιδραστήρα ψύχεται κατά την λειτουργία του, ούτως ώστε η (-ΔG) γίνεται μεγαλύτερη από την (-ΔΗ).
Κατ’ εφαρμογή των ανωτέρω προκύπτει, ότι ο βαθμός απόδοσης του αντιδραστήρα ψυχρής καύσης κατά την παραγωγή ηλεκτρικής ενέργειας είναι πολύ μεγαλύτερος ακόμα και από τον βαθμό απόδοσης ενός πυρηνοηλεκτρικού αντιδραστήρα.
Τέλος είναι δεδομένο, ότι η απόδοση των θερμικών μηχανών, ιδίως των μηχανών εσωτερικής καύσης και των στροβίλων, υπακούοντας στη περιοριστική διάταξη του κύκλου Carnot του δευτέρου νόμου της θερμοδυναμικής, εξαρτάται από το ύψος της θερμοκρασίας λειτουργίας τους.
Για παράδειγμα, η ως άνω περιοριστική – απαγορευτική διάταξη Carnot επιβάλλει ότι, για να αυξήσουν οι ανωτέρω θερμικές μηχανές το βαθμό απόδοσής τους στο 80%, πρέπει η θερμοκρασία λειτουργίας τους να φθάσει σε πολύ μεγάλα επίπεδα, ήτοι στους 2200Co η θερμή περιοχή και πάρα πολύ χαμηλά η ψυχρή περιοχή, δηλαδή μια τεράστια διαφορά μεταξύ της ψυχρής και της θερμής πλευράς (βλ. σχήμα 3 NASA). Φυσικά, για να επιτευχθούν αυτά χρειάζεται να καταναλώσουμε τεράστια ποσά ενέργειας, δηλαδή περισσότερα καύσιμα, οπότε οι θερμικές μηχανές και ιδίως οι μηχανές εσωτερικής καύσης συμβάλλουν ακόμη περισσότερο στην θερμική και τοξική μόλυνση του περιβάλλοντος.
Σε αντίθεση με τις θερμικές μηχανές, ο αντιδραστήρας ψυχρής καύσης είναι μια ισοθερμική στατική διάταξη, η οποία δεν εξαρτάται από μια θερμή και μια ψυχρή περιοχή (βλ. σχήμα 3 NASA), αφού με αυτήν την προτεινόμενη μέθοδο όσο ελαττώνεται αυτή η διαφορά, τόσο αυξάνει ο βαθμός απόδοσής του, ή καλλίτερα μειώνεται το ΔG. Συνεπώς, η περιοριστική διάταξη του κύκλου Carnot του 2ου νόμου της θερμοδυναμικής »παρακάμπτεται» και δεν μπορεί πλέον να εφαρμοστεί στον αντιδραστήρα ψυχρής καύσης που προτείνoυμε, διότι ο αντιδραστήρας αυτός είναι μια »στατική ισοθερμική διάταξη» παραγωγής ηλεκτρικής ενέργειας και ασφαλώς δεν είναι θερμική μηχανή ούτε περιλαμβάνεται στις θερμικές μηχανές, τις οποίες είχε υπ’ όψιν του ο Nicolas Leonard Sadi Carnot κατά την περίοδο (1824) που διατύπωνε την εν λόγω περιοριστική – απαγορευτική αρχή Carnot του 2ου θερμοδυναμικού νόμου, σύμφωνα με την οποία για να παραχθεί έργο απαιτούνται δύο δεξαμενές με διαφορά θερμοκρασίας, ήτοι μια θερμής και μια ψυχρής περιοχής (βλ. σχήμα 3 NASA)
Για τον λόγο αυτό, προτείνω στους επιστήμονες όλου του κόσμου, να στρέψουν τις έρευνές τους προς την κατεύθυνση μετατροπής της χημικής ενέργεια των καυσίμων απευθείας σε ηλεκτρική ενέργεια, παρακάμπτοντας την ως άνω περιοριστική διάταξη του κύκλου Carnot του 2ου νόμου της θερμοδυναμικής.
Έχει επέλθει πλέον το πλήρωμα του χρόνου, για να απεμπλακεί ο άνθρωπος από τις βλαβερές συνέπειες που προκαλούνται από την καύση των υδρογονανθράκων, που αποτελεί παράλληλα την κύρια αιτία της ενεργειακής σκλαβιάς της ανθρωπότητας και της συντελούμενης περιβαλλοντικής καταστροφής του πλανήτη.
* Ο Πέτρος Ζωγράφος είναι ειδικός ερευνητής.
ΠΗΓΗ: 20.09.2018, https://www.hellagen.gr/%CF%80%CE%B1%CF%81%CE%AC%CE%BA%CE%B1%CE%BC%CF%88%CE%B7/

